Konsep awal onkogen berasal dari penemuan susunan gen virus yang ekspresinya mengakibatkan sel terinfeksi virus tersebut berubah (transformasi) menjadi ganas. Penelitian-penelitian selanjutnya membuktikan bahwa susunan (sekuen) DNA dalam sel ganas menunjukkan homologi dengan DNA virus, sedangkan studi lain yang menggunakan metode gene transfer membenarkan bahwa sekuen DNA bersangkutan memberikan kontribusi untuk perkembangan sel ganas.
Onkogen terjadi melalui mutasi somatik proto-onkogen, - counterpart-nya yang tidak memiliki kemampuan transformasi - yang merupakan gen-gen yang memegang peran kunci pada proses pertumbuhan dan diferensiasi sel. Dalam sel normal ekspresi proto-onkogen ini diperlukan untuk perkembangan dan pertumbuhan sel normal dan tidak mengakibatkan keganasan karena aktivitasnya dikontrol secara ketat.
Aktivasi proto-onkogen menjadi onkogen dapat terjadi melalui perubahan struktural dalam gen, translokasi kromosom, amplifikasi gen atau mutasi dalam berbagai elemen yang dalam keadaan normal berfungsi mengontrol ekspresi gen bersangkutan. Mutasi proto-onkogen relatif sering terjadi dalam sel yang berproliferasi aktif, namun perubahan ke arah ganas dapat dicegah dengan bantuan ekspresi berbagai gen supresor (tumor suppressor genes atau anti-onkogen) yang berperan menginduksi terhentinya siklus sel atau menginduksi proses apoptosis.
Apabila fungsi gen-gen yang berperan dalam surveillance ini terganggu akibat mutasi atau hilang (deletion), sel bersangkutan menjadi rentan terhadap transformasi ganas. Namun demikian, terbukti pula bahwa kanker terjadi melalui proses bertahap dalam jangka waktu panjang, sehingga diduga bahwa keganasan terjadi apabila ada akumulasi kelainan berbagai gen yang saling melengkapi dan satu dengan lain berinteraksi untuk menghasilkan fenotip ganas.
Banyak fungsi seluler didasarkan atas fungsi transmisi sinyal pertumbuhan yang diinduksi oleh faktor pertumbuhan dengan berikatan pada reseptornya pada membran sel kemudian sinyal tersebut diteruskan, melalui proses kaskade fosforilasi dan defosforilasi protein dalam sitoplasma, ke nukleus. Karena itu perhatian penelitian tentang onkogen difokuskan kepada berbagai gen yang terlibat dalam transduksi sinyal tersebut sebagai onkogen potensial.
Dari berbagai penelitian itu terungkap bahwa prototip onkogen- onkogen ini menyandi berbagai faktor pertumbuhan, hormon dan masing-masing reseptornya, serta berbagai faktor transkripsi. Produk protein dari proto-onkogen dan variannya yang memiliki kemampuan transformasi (onkogen) diklasifikasikan berdasarkan lokasi subseluler atau aktivitas biokimianya, yaitu:
PERUBAHAN PROTO-ONKOGEN MENJADI ONKOGEN
Proto-onkogen disebut demikian apabila terbukti bahwa ia dapat di konversikan menjadi onkogen dan sebagai konsekuensinya ia memperoleh kemampuan untuk mentransformasikan sel menjadi ganas.
Berbagai proses dapat merusak gen yang bertanggung jawab atas perubahan proto-onkogen menjadi onkogen, di antaranya sebagai berikut :
1. Aktivasi Akibat Reduplikasi
Transduksi dan penyisipan retrovirus (insertional mutagenesis). Pada gambar 1 tampak bahwa gen c-myc dapat diaktivasi apabila terjadi reduplikasi DNA secara abnormal atau amplifikasi (kiri atas), atau apabila terjadi translokasi c-myc ke lokasi di kromosom lain berdekatan dengan gen yang memiliki kemampuan meningkatkan fungsi, misalnya translokasi c-myc dari kromosom 8 ke kromosom 14 dekat lokasi gen Ig.
Pada keadaan ini, gen Ig berfungsi meningkatkan aktivitas c-myc ( kanan atas). Peningkatan aktivitas c- myc juga dapat terjadi akibat penyisipan DNA virus, misalnya dalam contoh DNA-ALV (kiri bawah), atau akibat transduksi retrovirus (kanan bawah). Penyisipan dan transduksi menyebabkan perubahan fungsi proto-onkogen (dalam contoh ini c-myc) yang letaknya berdekatan sehingga menjadi onkogenik.
Gambar 1: Beberapa cara konversi proto-onkogen c-myc menjadi onkogen.

Transduksi retrovirus (gambar 2) dapat mengubah proto-onkogen c-myc menjadi onkogen melalui sedikitnya 3 cara. yaitu :

Fenomena pertama dan kedua merupakan konsekuensi rekombinasi awal yang menanamkan proto-onkogen ke dalam genom virus. Fenomena ketiga terjadi akibat perubahan yang disebabkan proses transduksi itu sendiri dan mutagenesis yang terjadi selama perkembangan virus selanjutnya.
Perkembangan virus seringkali mengalami kesalahan sehingga berakibat mutagenesis pada berbagai bagian gen virus termasuk pada proto-onkogen yang ditransduksinya. Mutagenesis akibat penyisipan virus ini mengubah proto-onkogen menjadi onkogen terutama karena onkogen itu dikendalikan oleh genom virus yang memiliki kemampuan kuat untuk mengekspresikan gen bersangkutan. Hasilnya adalah bahwa gen yang semula “silent” menjadi aktif atau diekspresikan secara berlebihan. Dengan kata lain, penyisipan DNA virus dapat menyebabkan peningkatan produksi RNA dan protein oleh proto-onkogen secara berlebihan.
Pada umumnya penyisipan genom virus juga menyebabkan kerusakan pada domain sandi sehingga menghasilkan produk protein yang abnormal. Myc hasil transduksi di atas (gambar 2) merupakan contoh bagaimana proto-onkogen di konversi menjadi onkogen. Fungsi transkripsi onkogen myc berada di bawah kendali virus, mengalami fusi dengan gen struktural virus membentuk hibrid yang menghasilkan protein hibrid yang abnormal, dan mengalami mutasi pada domain sandi. Semua perubahan ini dapat meningkatkan tumorigenesis.
2. Aktivasi Akibat Translokasi Kromosom
Translokasi dapat mempengaruhi proto-onkogen melalui 2 cara. Cara pertama menyebabkan berpindahnya gen ke pusat kendali transkripsi yang kuat sehingga ekspresi gen meningkat.
Prototip kelainan ini dijumpai pada limfoma Burkit di mana gen myc pindah ke tempat berdekatan dengan pusat kontrol transkripsi gen imunoglobulin (Ig). Ekspresi c-myc juga meningkat bila ia pindah ke lokasi yang berdekatan dengan gen reseptor sel T (TCR) seperti sering dijumpai pada leukemia sel T.
Cara kedua adalah apabila potongan-potongan gen yang berpindah tempat melakukan fusi dan menghasilkan protein hibrid, mirip dengan pembentukan hibrid potongan gen seluler dengan gen struktural virus (gambar 2).
Terjadinya kromosom Philadelphia merupakan contoh kelainan yang terjadi dengan cara ini, di mana proto-onkogen abl melakukan fusi dengan abl dan membentuk onkogen bcr-abl (gambar 3), sehingga dalam hal ini translokasi mengakibatkan perubahan struktur gen dan pembentukan protein abnormal.
Gambar 3 : Kromosom Philadelphia. Proto-onkogen abl pindah (translokasi) dari kromosom 9 ke lokus bcr pada kromosom 22

Dalam melakukan fusi tidak selalu kedua bagian gen hibrid itu memberikan kontribusi pada aktivitas biokimiawi protein hibrid, salah satu bagian mungkin saja merupakan bagian yang pasif, misalnya hanya mengganggu fungsi atau menggantikan domain yang fungsional.
Translokasi tidak selalu menghasilkan fusion gene, tetapi mengakibatkan ekspresi gen bersangkutan meningkat karena diaktivasi oleh proto-onkogen yang berdekatan yang fungsinya meningkatkan ekspresi gen. Contoh yang baik adalah translokasi gen c-myc dari kromosom 8 ke kromosom 14, atau translokasi gen bcl2 dari kromosom 18 ke kromosom 14 dekat lokasi gen IgH. (gambar 4)
Gambar 4: Translokasi bcl2 dari kromosom 18 ke kromosom 14 pada lokasi gen IgH terjadi pada limfoma folikuler.

3. Aktivasi Akibat Amplifikasi Gen
Amplifikasi proto-onkogen meningkatkan jumlah template yang diperlukan untuk transkripsi mRNA. sehingga dengan demikian meningkatkan jumlah produk yang dihasilkan oleh sel.
Karena amplifikasi bisa sampai lebih dari 100 kali, produk gen yang dihasilkan juga menjadi banyak. Di samping itu, beberapa alel yang diamplifikasi biasanya mengalami mutasi pada domain sandi sebelum terjadi amplifikasi, sehingga mutasi tersebut juga turut diamplifikasi. Amplifikasi gen semacam ini sering dijumpai pada berbagai jenis kanker
4. Aktivasi Akibat Point Mutation
Banyak tumor pada manusia mengandung gen ras yang mengalami point mutation yang mengubah satu residu asam amino, biasanya pada residu 12, 13 atau 61. Point mutation ini telah terbukti bertanggung jawab atas terjadinya transformasi dengan kemampuan lebih dari 100 kali lipat.
Aktivasi gen ras akibat mutasi ini sering dijumpai pada kanker. Proto-onkogen ret merupakan contoh lain tentang bagaimana point mutations dapat mengaktifkan onkogen. Ret menyandi reseptor permukaan yang memiliki domain intrasitoplasmik dan domain ekstraseluler. Domain intrasitoplasmik reseptor ini merupakan protein kinase yang dapat diaktifkan dengan pengikatan domain ekstrasel oleh ligand-nya.
Mutasi gen ret mengakibatkan domain ekstrasel hilang dan domain intrasel berada dalam keadaan aktif terus menerus; di samping itu domain ini kehilangan spesifisitas kinase, sehingga dapat dianggap sebagai salah satu contoh perubahan kualitatif gen akibat mutasi. Mutasi ret dikaitkan dengan tumor endokrin herediter, termasuk di antaranya multiple endocrine neoplasia (MEN) tipe IIA dan IIB.
PATOGENESIS PERUBAHAN PROTO-ONKOGEN MENJADI ONKOGEN
Seperti telah diuraikan di atas berbagai cara dapat mengubah proto-onkogen menjadi onkogen. Ada 2 hipotesis bagaimana perubahan itu mengakibatkan gangguan fungsi gen.
Hipotesis yang pertama adalah model kuantitatif, di mana patogenesis disebabkan oleh meningkatnya aktivitas gen dan produknya, sedangkan hipotesis kedua didasarkan atas perubahan spesifisitas atau fungsi sebenarnya dari produk gen bersangkutan.
Banyak kanker yang disebabkan perubahan gen secara kuantitatif, dan pada umumnya perubahan itu disebabkan mutasi yang berakibat peningkatan fungsi (gain of function mutations), sehingga gen bersangkutan diekspresikan berlebihan dan berfungsi secara terus menerus.
Berbeda dengan mutasi gen supresor (tumor suppresor genes) yang pada kanker umumnya mengalami inaktivasi atau loss of function, pada onkogen umumnya terjadi gain of function.
Ada beberapa bentuk aktivitas berlebihan,, yaitu: gain of function melalui kelainan ekspresi gen atau gain of function melalui perubahan struktur protein.
PERAN ONKOGEN PADA TUMORIGENESIS
Sel mamalia pada umumnya berada dalam keadaan tenang sampai sel itu menerima sinyal dari luar yang mengubah perilakunya secara spesifik.
Karena itu, pertumbuhan sel, diferensiasi dan seringkali juga ketahanan hidup sebuah sel normal bergantung pada sinyal-sinyal eksternal tersebut. Proses komunikasi sel itu mulai bila satu sel memproduksi molekul sinyal, seringkali dalam bentuk hormon, yang kemudian berikatan dengan reseptor bagi sinyal bersangkutan yang terdapat pada permukaan sel sasaran.
Pengikatan hormon pada reseptornya mengubah reseptor dari keadaan dorman menjadi keadaan aktif dengan cara merangsang fungsi biokimiawi intrinsik reseptor bersangkutan. Reseptor yang teraktivasi kemudian memodifikasi jalur sinyal yang mengontrol ekspresi gen, siklus sel, metabolisme, struktur sitoskeleton, adhesi maupun migrasi sel dan dalam keadaan normal aktivasi dan inaktivasi jalur ini diatur melalui fosforilasi dan defosforilasi secara bergantian sesuai kebutuhan.
Diduga bahwa proto- onkogen tertentu menyandi produk-produk yang merupakan unsur-unsur penting dalam jalur traaansduksi sinyal pertumbuhan, dan bahwa mutasi yang mengakibatkan peningkatan aktivitas jalur ini dapat mengubah proto-onkogen menjadi onkogen.
Mutasi onkogenik mengubah kemampuan sandi gen-gen bersangkutan sehingga protein yang diproduksinya mengalami berbagai perubahan. Salah satu perubahan seperti telah diuraikan di atas adalah diekspresikannya gen secara terus menerus dan protein yang dihasilkannya yang disebut secara umum onkoprotein, kehilangan kemampuan untuk mengatur fosforilasi/ defosforilasi. Ekspresi terus menerus gen-gen bersangkutan di interpretasikan oleh sel sebagai sinyal untuk terus tumbuh, karena itu onkogen mempunyai dampak dominan positif bagi pertumbuhan sel dengan menirukan fungsi sinyal mitogenik.
Onkogen yang terlibat dalam transduksi sinyal
Identifikasi berbagai onkogen yang terlibat dalam pertumbuhan kanker disusul kemudian dengan bertambahnya pemahaman mengenai fungsi berbagai onkogen bersangkutan. Beberapa gen yang sering merupakan sasaran lesi onkogenik adalah gen yang terlibat dalam transduksi sinyal. Mutasi onkogenik seringkali melibatkan gen yang menyandi faktor pertumbuhan dan atau reseptornya, protein yang meneruskan sinyal transduksi dalam sitoplasma hingga ke nukleus
Golongan faktor pertumbuhan
Hubungan pertama antara onkogen dengan protein seluler yang aktivitas fisiologiknya sudah dikenal adalah penemuan produk onkogen sis yang dikenal sebagai PDGF (platelet derived growth factor).
PDGF merupakan faktor pertumbuhan utama bagi fibroblast dalam biakan sel. Gen sis pertama kali diidentifikasi sebagai onkogen simian sarcoma virus, yang diisolasi dari fibrosarkoma berasal dari monyet. Penelitian- penelitian selanjutnya membuktikan bahwa ada kesamaan antara protein produk onkogen sis dengan PDGF dalam hal sekuen asam amino, sehingga kedua protein itu dianggap homolog.
Penelitian tentang aktivitas biologik proto-onkogen sis menunjukkan bahwa apabila protein produk sis ini direkayasa secara molekuler, ia mampu menginduksi transformasi sel.. Hal itu membuktikan bahwa sis/PDGF menginduksi transformasi ganas dengan merangsang jalur transduksi faktor pertumbuhan normal secara terus menerus. Hal penting lain yang dibuktikan adalah bahwa produk gen sis dapat berikatan dengan reseptornya secara internal yang berakibat stimulasi autokrin.
Faktor pertumbuhan lain yang juga berperan pada transformasi adalah keluarga faktor pertumbuhan fibroblast (FGF), faktor pertumbuhan epidermal (EGF) dan faktor pertumbuhan hemopoetik. Faktor pertumbuhan hemopoetik dapat menjadi onkogenik melalui penyisipan promoter retrovirus, misalnya pada leukemia.
Sasaran sisipan retrovirus adalah faktor pertumbuhan sel T (IL-2), CSF (IL-3), GM-CSF dan M-CSF. (lihat tabel 2)
Tabel 2: Faktor pertumbuhan yang mempunyai potensi onkogenik *
Golongan reseptor faktor pertumbuhan
Telah diketahui bahwa proses aktivasi reseptor faktor pertumbuhan terjadi melalui dimerisasi. Gen reseptor faktor pertumbuhan yang mengalami mutasi menghasilkan reseptor abnormal. Dari berbagai penelitian dapat diketahui bahwa reseptor faktor pertumbuhan yang dihasilkan oleh gen mutant (onkogen) dapat kehilangan beberapa bagian N-terminal atau C-terminal, atau mengalami substitusi beberapa asam amino, tetapi tetap mempertahankan domain PTK (protein tirosin kinase) utuh yang terus menerus aktif. Selain substitusi, gen ini juga sering mengalami rekombinasi.
Salah satu contoh di antaranya adalah onkogen c-erbB yang menghasilkan onkoprotein EGFR abnormal berupa reseptor tanpa domain ekstraseluler. Onkogen neu (disebut juga erb-B2 atau HER-2) mengalami single point mutation yang mengubah valine pada residu transmembran menjadi asam glutamat. Substitusi ini menginduksi dimerisasi onkoprotein neu pada membran sel sehingga menyerupai induksi proses aktivasi oleh pengikatan dengan faktor pertumbuhan.
Konsekuensinya adalah terjadi aktivasi walaupun tidak ada rangsangan faktor pertumbuhan dari luar. Contoh onkogen reseptor PTK yang lain adalah onkogen ret seperti telah disinggung di atas yang berperan pada kanker endokrin herediter (multiple endocrine neoplasia). Onkogen ret ini merupakan pengecualian onkogen yang diturunkan, karena pada umumnya hanya kelainan pada tumor suppressor gene yang dikaitkan dengan kanker herediter.
Golongan protein tirosin kinase intrasitoplasmik
Golongan ini juga disebut protein-tirosin kinase (PTK) non-reseptor. Gen golongan ini menyandi protein-tirosin kinase yang tidak terdapat atau menembus membran sel tetapi terdapat di dalam sitoplasma, beberapa di antaranya berhubungan dengan bagian sitoplasmik dari membran sel.
Aktivitas kinase dan kemampuan transformasi gen ini dikontrol melalui fosforilasi dan defosforilasi pada 2 residu penting tirosin, yaitu tirosin-416 dan tirosin-527. Kehilangan fungsi kontrol ini menyebabkan aktivitas kinase meningkat dan dapat berakhir dengan transformasi sel. Termasuk golongan ini adalah keluarga Src, Lck dan lain-lain
Salah satu PTK intrasitoplasmik yang sudah sangat dikenal adalah gen abl yang sudah diuraikan di atas. Konsekuensi fusi abl dengan bcr (lihat gambar 3) adalah bahwa bcr meningkatkan oligomerisasi protein Bcr-Abl dan aktivasi domain tirosin kinase dari Abl melalui autofosforilasi. Akibat autofosforilasi ini, protein Bcr-Abl berikatan dengan protein Grb2 yang berfungsi sebagai protein sinyal sehingga menginduksi proliferasi dan memperpanjang ketahanan hidup.
Golongan transduser intraseluler (pengikat guanine)
Salah satu jenis gen yang menduduki tempat penting dalam riset awal kanker adalah gen RAS. Fungsi RAS yang pertama kali diketahui adalah kemampuannya untuk mengikat nukleotida guanine. Mutasi gen RAS yang mengakibatkan aktivasi berlebihan merupakan kelainan genetik yang paling sering dijumpai pada kanker, dan karena fungsinya yang amat penting pada pertumbuhan kanker, berbagai penelitian tentang RAS telah dilakukan dan mengungkapkan berbagai jalur ras dalam transduksi sinyal dalam sel (gambar 5, dimodifikasi dari Perkins & Stern.)
Gambar 5: Diagram jalur RAS. Huruf-huruf yang dicetak miring adalah contoh onkogen atau gen dengan kemampuan transformasi bila diekspresikan berlebihan atau di-amplifikasi .
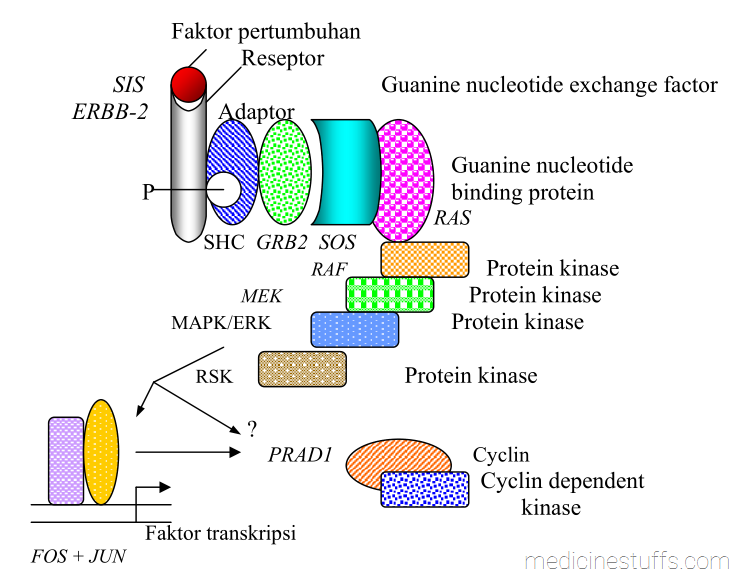
Mengambil contoh gen RAS di atas, salah satu mutasi yang sering dialaminya adalah point mutation yang mengubah asam amino Gly menjadi Val pada posisi 12, 13 atau 59 hingga 61. Pada beberapa dari posisi ini, khususnya posisi 12 dan 61, substitusi berbagai jenis asam amino meningkatkan potensi Ras untuk transformasi. Pada umumnya mutasi-mutasi ini mengganggu hidrolisis GTP pada siklus pertukaran RAS-GNP (gambar 6)
Gambar 6: Interaksi protein Ras dengan guanine nucleotide

Mutasi yang mengakibatkan aktivasi Ras berlebihan (activating mutation) menurunkan aktivitas GTPase atau meningkatkan kecepatan pertukaran GDP terikat dengan GTP bebas. Keduanya diduga meningkatkan jumlah GTP terikat dan karena itu meningkatkan aktivitas Ras.
Dari analisis struktur protein Ras terungkap bahwa asam amino yang terkena mutasi adalah bagian protein Ras yang mengikat guanine sehingga berakibat protein Ras berada dalam keadaan terikat dengan GTP dan karenanya berada dalam keadaan terus menerus aktif dan meneruskan sinyal pertumbuhan.
Banyak protein lain yang termasuk transduser intraseluler, misalnya protein serine/threonine kinase, bahkan sebagian besar aktivitas protein-kinase seperti disebut di atas pada sel mamalia berakibat fosforilasi serine-/threonine kinase . Lebih dari 100 jenis enzim serine/threonine kinase telah ditemukan, sebagian besar di antaranya berperan penting pada berbagai jenis proses metabolisme.
Salah satu di antara onkogen yang menyandi golongan enzim ini adalah keluarga onkogen raf. Ada 3 jenis onkogen raf, yaitu c-raf-1, A-raf dan B-raf, Ketiga jenis protein yang dibentuknya identik dalam domain kinase yang terletak pada bagian carboxy-terminal masing-masing protein, dan bagian inilah yang mengatur aktivitas Raf -kinase. Mutasi yang mengubah proto-onkogen raf menjadi onkogen pada umumnya terjadi akibat hilangnya (deletion) sekuen amino- terminal dari gen tersebut (gambar 7) yang merupakan domain yang mempunyai aktivitas katalitik (negative regulatory domain).
Gambar 7: Proto-onkogen c-raf-1 dikonversikan menjadi onkogen aktif akibat hilangnya domain regulator amino-terminal.

Gen raf yang buntung ini dapat diaktifkan melalui fusi dengan sekuen gag suatu virus atau fusi dengan berbagai sekuen sandi seluler dalam onkogen raf yang telah diaktifkan pada waktu transfer gen bersangkutan. Tetapi sebenarnya gen raf yang buntung itu sendiri sudah cukup untuk mengaktifkan potensi transformasi onkogen raf. Mutan dengan kemampuan transformasi paling tinggi menunjukkan kehilangan hampir seluruh domain amino-terminal. Hilangnya domain katalitik ini menyebabkan domain kinase berada dalam keadaan terus menerus aktif.
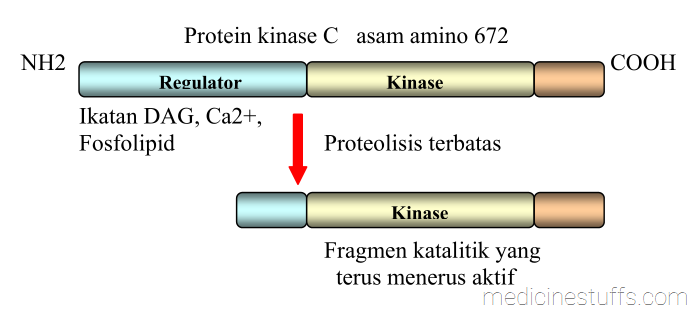
Gen lain dalam golongan serine/threonine kinase adalah keluarga protein kinase C (PKC). Pada saat ini telah diketahui sedikitnya 3 anggota keluarga PKC yang berbeda satu dengan lain dalam aktivitas katalitik maupun fungsinya sebagai regulator. Aktivitas katalitik isotip PKC yang klasik (α, β1, β2 dan γ) memerlukan pengikatan baik dengan kalsium maupun diacylglycerol (DAG), Tetapi PKC yang lainnya seperti PKC-δ dan PKC−ε tidak bergantung pada kalsium dan hanya memerlukan DAG bagi aktivitasnya. Beberapa penelitian membuktikan bahwa PKC juga dapat diaktifkan oleh proteolisis terbatas, sehingga didugaenzim itu mempunyai domain regulator dan katalitik yang berbeda-beda (gambar 8)
Gambar 8: Struktur PKC.
Baik raf maupun PKC berfungsi sebagai efektor penerus sinyal yang dimulai dari pengikatan faktor pertumbuhan dengan reseptornya, melalui aktivasi ras kemudian meneruskan sinyal tersebut melalui kaskade aktivasi enzim-enzim yang terlibat dan berakhir dengan proliferasi sel.
Onkogen nukleus
Onkogen golongan ini merupakan komponen nukleus dari jalur transduski sinyal. Proses pertumbuhan yang berlangsung melalui suatu siklus sel dikendalikan secara ketat, periodik dan spesifik / sesuai fase siklus sel oleh banyaknya dan aktivitas protein tertentu. Di antara protein-protein tersebut termasuk berbagai cyclin dan cyclin dependent kinase (cdk) dan inhibitornya serta faktor transkripsi AP-1 yang terdiri atas jun dan fos.
Pengaturan yang ketat dari siklus sel juga melibatkan berbagai gen yang menyandi berbagai protein yang diperlukan untuk metabolisme dan replikasi DNA, misalnya thymidine kinase, DNA polymerase-α, DNA polimerase-δ dan histone. Pengaturan komponen penting dari mesin siklus sel ini terjadi melalui berbagai mekanisme yang saling terkait, yaitu modifikasi pasca-translasi, hubungan dengan berbagai protein regulator yang bersifat spesifik sesuai stadium (stage specific), degradasi periodik, ekspresi gen yang diinduksi secara berulang dan lain-lain.
Salah satu cara pengaturan faktor transkripsi oleh mesin siklus sel adalah melalui modulasi aktivitas protein E2F oleh kompleks cyclin-cdk. Inaktivasi E2F dilakukan dengan melepaskan pengikatan protein ini dengan RB1 dengan cara fosforilasi Rb1 dengan bantuan cyclin-cdk. Selain itu sebagian protein E2F dapat merupakan substrat langsung bagi kompleks cyclin-cdk spesifik dan fsoforilasinya melepaskan ikatan protein itu dengan DNA. 10 E2F dapat berfungsi sebagai represor maupun aktivator pertumbuhan sesuai dengan fase siklus sel.
Contoh lain adalah c-myc seperti telah disebut di atas, c- fos dan jun serta AP-1. Gambar 9 memperlihatkan bagaimana protein Rb dan kompleks cyclin-cdk mengatur aktivasi faktor-faktor transkripsi.
Gambar 9: Model pengaturan aktivator transkripsi spesifik sekuen oleh pRb dan cdk.
Gambar 9 memperlihatkan bahwa :
Dalam golongan ini termasuk faktor transkripsi yang berfungsi baik sebagai regulator positif pertumbuhan sel maupun berperan sebagai regulator negatif diferensiasi sel. Karena fungsi terakhir ini yang agaknya dominan maka ia diberi nama Id (inhibitors of cell differentiation).
Protein Id-helix-loop-helix merupakan antagonis dominan-negatif bagi faktor transkripsi golongan HLH lain yang fungsinya merangsang perkembangan sel sesuai komitmennya menjadi berbagai lineage dan stadium diferensiasi yang diprogramkan. Tetapi Id-helix-loop-helix (Id-HLH) tidak memiliki domain basa seperti di atas karena itu ia berperan sebagai regulator negatif diferensiasi. Fungsi Id helix-loop-helix di-integrasikan dengan jalur pengaturan siklus sel dibawah kendali cyclin dependent kinase dan protein retinoblastoma.
Gambar 10: Protein Id sebagai antagonis dominan-negatif regulator transkripsi bHLH.

Dalam gambar 10 diperlihatkan :
PERAN ONKOGEN DALAM METABOLISME SEL TUMOR
Selain berperan dalam pertumbuhan dan diferensiasi sel. onkogen tertentu juga berperan dalam metabolisme sel. Sejak lama diketahui bahwa sel-sel kanker menunjukkan kelainan dalam pola metabolisme dan menunjukkan uptake glukosa dan glikolisis lebih tinggi dibanding sel-sel normal. Walaupun perubahan metabolik ini bukan merupakan dasar terjadinya kanker, perubahan metabolisme ini dapat mengakibatkan sel- sel kanker dapat hidup terus dan mampu melakukan invasi.
Gambar 11: Peran onkogen dalam metabolisme tumor.
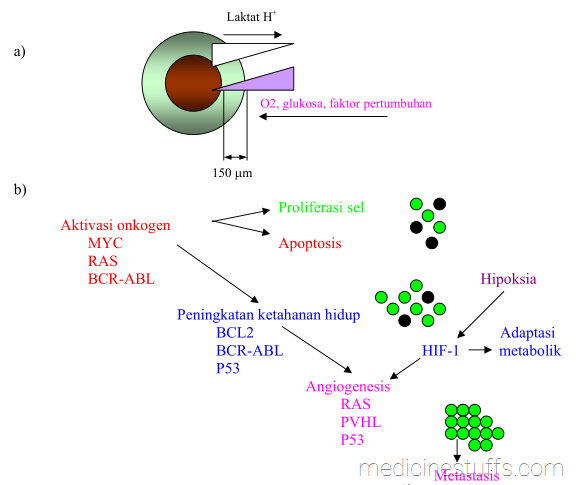
Sel yang mengalami transformasi ganas dan kelainan genetik memerlukan metabolisme khusus untuk berkembang menjadi masa tumor dalam 3 dimensi. Tumor kecil (diameter < 1 mm) maupun bagian-bagian kecil dari tumor besar seringkali memiliki lingkungan mikro yang menunjukkan berbagai metabolit penting seperti oksigen, glukosa dan faktor pertumbuhan. (gambar 11 a) Gambar 11b menunjukkan perubahan berbagai gen yang terlibat dalam pertumbuhan tumor.
Aktivasi beberapa onkogen mengakibatkan deregulasi proliferasi sel, yang seringkali dihubungkan dengan apoptosis bila tidak tersedia faktor pertumbuhan. Hasilnya adalah peningkatan apoptosis (bola hitam), yang menyebabkan tumor tidak bertambah besar. Peningkatan ketahanan hidup sel sebagai akibat perubahan genetik yang mencegah apoptosis, misalnya aktivasi BCL2 atau kehilangan p53, menyebabkan tumor bertambah besar.
Aktivasi faktor transkripsi yang diinduksi oleh hipoksia (hipoxia-inducible transcription factor, HIF-1) akibat hipoksia atau onkogen tertentu menginduksi faktor adaptasi metabolik dan angiogenik, yang mengakibatkan terbentuknya pembuluh-pembuluh darah baru. Akhirnya sel bermigrasi, masuk ke dalam pembuluh darah dan bermetastasis.
Onkogen myc yang seringkali diekspresikan berlebihan pada kanker menyandi faktor transkripsi yang membentuk heterodimer dengan onkogen max untuk mengikat sekuen 5’-GACGTG-3’. Dari berbagai penelitian terungkap bahwa gen LDH-A merupakan sasaran gen myc, dan ekspresinya pada kanker sering meningkat, bahkan sejak lama LDH-A digunakan sebagai petanda adanya transformasi ganas. Ekspresi gen LDH-A diinduksi oleh hipoksia melalui aktivasi HIF-1. Gen myc juga diketahui meningkatkan glikolisis dan produksi laktat.
Aktivasi onkogen H-ras juga menyebabkan peningkatan glikolisis aerobik, merangsang transkripsi gen yang menyandi VEGF (vascular endothelial growth factor) dengan bantuan HIF-1. (gambar 12)
Gambar 12: Tempat pengikatan faktor transkripsi dalam promoter proksimal gen yang menyandi LDH-A. 13

Pada gambar 12 tampak bahwa E-box (5’CACGTG-3’) merupakan inti dari carbohydrate response element yang tumpang tindih dengan tempat pengikatan faktor transkripsi HIF-1, MYC-MAX dan USF. MYC dan HIF-1 dapat secara langsung mengikat elemen cis, sedangkan v-SRC dan H-RAS teraktivasi meningkatkan aktifitas HIF-1 dan faktor-faktor lain yang berikatan dengan elemen-elemen ini dan mengaktivasi glikolisis.
Dengan demikian terbukti bahwa di samping mengakibatkan pertumbuhan tak terkendali dan menimbulkan fenotip abnormal, ekspresi berlebihan beberapa jenis onkogen juga dapat meningkatkan ekspresi berbagai faktor transkripsi yang mengatur produksi berbagai enzim metabolik dan faktor-faktor angiogenik yang diperlukan untuk kehidupan sel-sel kanker selanjutnya.
RINGKASAN
Onkogen adalah bentuk abnormal dari proto-onkogen, yang mempunyai sifat biologis berbeda dari counterpartnya, yaitu memiliki kemampuan untuk transformasi sel menjadi ganas. Perubahan sifat itu dapat disebabkan pertama oleh perubahan kuantitatif, yaitu amplifikasi atau diekspresikan berlebihan, dan kedua oleh perubahan kualitatif, yaitu peningkatan fungsi.
Berbagai mekanisme dapat menyebabkan peningkatan ekspresi dan atau fungsi onkogen, antara lain: translokasi gen ke kromosom lain yang berakibat gen bersangkutan diaktivasi terus menerus, penyisipan (insertion) maupun transduksi gen virus yang juga mengakibatkan hiperaktivitas onkogen bersangkutan. Pada umumnya onkogen diklasifikasikan menurut fungsinya dalam sel.
Onkogen yang berperan dalam tumorigenesis adalah onkogen yang memegang peran penting dalam proses pertumbuhan dan diferensiasi sel, mulai dari gen yang menyandi berbagai faktor pertumbuhan, reseptor faktor pertumbuhan, berbagai enzim intraseluler yang berfungsi dalamtransdusi sinyal maupun faktor transkripsi.
Di samping berperan dalam tumorigenesis, berbagai onkogen juga memegang peran penting dalam metabolisme sel-sel kanker. Produk berbagai onkogen sering secara langsung mempengaruhi metabolisme sel seperti transpor glukosa, glikolisis dan proses metabolisme lain.
Onkogen terjadi melalui mutasi somatik proto-onkogen, - counterpart-nya yang tidak memiliki kemampuan transformasi - yang merupakan gen-gen yang memegang peran kunci pada proses pertumbuhan dan diferensiasi sel. Dalam sel normal ekspresi proto-onkogen ini diperlukan untuk perkembangan dan pertumbuhan sel normal dan tidak mengakibatkan keganasan karena aktivitasnya dikontrol secara ketat.
Aktivasi proto-onkogen menjadi onkogen dapat terjadi melalui perubahan struktural dalam gen, translokasi kromosom, amplifikasi gen atau mutasi dalam berbagai elemen yang dalam keadaan normal berfungsi mengontrol ekspresi gen bersangkutan. Mutasi proto-onkogen relatif sering terjadi dalam sel yang berproliferasi aktif, namun perubahan ke arah ganas dapat dicegah dengan bantuan ekspresi berbagai gen supresor (tumor suppressor genes atau anti-onkogen) yang berperan menginduksi terhentinya siklus sel atau menginduksi proses apoptosis.
Apabila fungsi gen-gen yang berperan dalam surveillance ini terganggu akibat mutasi atau hilang (deletion), sel bersangkutan menjadi rentan terhadap transformasi ganas. Namun demikian, terbukti pula bahwa kanker terjadi melalui proses bertahap dalam jangka waktu panjang, sehingga diduga bahwa keganasan terjadi apabila ada akumulasi kelainan berbagai gen yang saling melengkapi dan satu dengan lain berinteraksi untuk menghasilkan fenotip ganas.
Banyak fungsi seluler didasarkan atas fungsi transmisi sinyal pertumbuhan yang diinduksi oleh faktor pertumbuhan dengan berikatan pada reseptornya pada membran sel kemudian sinyal tersebut diteruskan, melalui proses kaskade fosforilasi dan defosforilasi protein dalam sitoplasma, ke nukleus. Karena itu perhatian penelitian tentang onkogen difokuskan kepada berbagai gen yang terlibat dalam transduksi sinyal tersebut sebagai onkogen potensial.
Dari berbagai penelitian itu terungkap bahwa prototip onkogen- onkogen ini menyandi berbagai faktor pertumbuhan, hormon dan masing-masing reseptornya, serta berbagai faktor transkripsi. Produk protein dari proto-onkogen dan variannya yang memiliki kemampuan transformasi (onkogen) diklasifikasikan berdasarkan lokasi subseluler atau aktivitas biokimianya, yaitu:
- Faktor pertumbuhan
- Reseptor faktor pertumbuhan dengan aktivitas tirosin kinase
- Protein tirosin kinase sitoplasmik
- Protein pengikat guanin (guanine binding protein) yang melekat pada membran sel
- Protein kinase spesifik serine-threonin terlarut yang terdapat dalam sitoplasma
- Protein nukleus. Hingga saat ini telah ditemukan lebih dari 150 jenis onkogen yang berperan dalam transformasi sel, walaupun mekanismenya belum sel;uruhnya terungkap.
PERUBAHAN PROTO-ONKOGEN MENJADI ONKOGEN
Proto-onkogen disebut demikian apabila terbukti bahwa ia dapat di konversikan menjadi onkogen dan sebagai konsekuensinya ia memperoleh kemampuan untuk mentransformasikan sel menjadi ganas.
Berbagai proses dapat merusak gen yang bertanggung jawab atas perubahan proto-onkogen menjadi onkogen, di antaranya sebagai berikut :
1. Aktivasi Akibat Reduplikasi
Transduksi dan penyisipan retrovirus (insertional mutagenesis). Pada gambar 1 tampak bahwa gen c-myc dapat diaktivasi apabila terjadi reduplikasi DNA secara abnormal atau amplifikasi (kiri atas), atau apabila terjadi translokasi c-myc ke lokasi di kromosom lain berdekatan dengan gen yang memiliki kemampuan meningkatkan fungsi, misalnya translokasi c-myc dari kromosom 8 ke kromosom 14 dekat lokasi gen Ig.
Pada keadaan ini, gen Ig berfungsi meningkatkan aktivitas c-myc ( kanan atas). Peningkatan aktivitas c- myc juga dapat terjadi akibat penyisipan DNA virus, misalnya dalam contoh DNA-ALV (kiri bawah), atau akibat transduksi retrovirus (kanan bawah). Penyisipan dan transduksi menyebabkan perubahan fungsi proto-onkogen (dalam contoh ini c-myc) yang letaknya berdekatan sehingga menjadi onkogenik.
Gambar 1: Beberapa cara konversi proto-onkogen c-myc menjadi onkogen.

Transduksi retrovirus (gambar 2) dapat mengubah proto-onkogen c-myc menjadi onkogen melalui sedikitnya 3 cara. yaitu :
- Bila ekspresi gen bersangkutan dikendalikan oleh genom virus
- Melalui fusi sebagian atau seluruh gen dengan genom virus dan menghasilkan gen hibrid dan produk protein hibrid
- Menyebabkan kerusakan DNA setempat, misalnya point mutation atau deletion pada domain sandi gen bersangkutan (coding domain).

Fenomena pertama dan kedua merupakan konsekuensi rekombinasi awal yang menanamkan proto-onkogen ke dalam genom virus. Fenomena ketiga terjadi akibat perubahan yang disebabkan proses transduksi itu sendiri dan mutagenesis yang terjadi selama perkembangan virus selanjutnya.
Perkembangan virus seringkali mengalami kesalahan sehingga berakibat mutagenesis pada berbagai bagian gen virus termasuk pada proto-onkogen yang ditransduksinya. Mutagenesis akibat penyisipan virus ini mengubah proto-onkogen menjadi onkogen terutama karena onkogen itu dikendalikan oleh genom virus yang memiliki kemampuan kuat untuk mengekspresikan gen bersangkutan. Hasilnya adalah bahwa gen yang semula “silent” menjadi aktif atau diekspresikan secara berlebihan. Dengan kata lain, penyisipan DNA virus dapat menyebabkan peningkatan produksi RNA dan protein oleh proto-onkogen secara berlebihan.
Pada umumnya penyisipan genom virus juga menyebabkan kerusakan pada domain sandi sehingga menghasilkan produk protein yang abnormal. Myc hasil transduksi di atas (gambar 2) merupakan contoh bagaimana proto-onkogen di konversi menjadi onkogen. Fungsi transkripsi onkogen myc berada di bawah kendali virus, mengalami fusi dengan gen struktural virus membentuk hibrid yang menghasilkan protein hibrid yang abnormal, dan mengalami mutasi pada domain sandi. Semua perubahan ini dapat meningkatkan tumorigenesis.
2. Aktivasi Akibat Translokasi Kromosom
Translokasi dapat mempengaruhi proto-onkogen melalui 2 cara. Cara pertama menyebabkan berpindahnya gen ke pusat kendali transkripsi yang kuat sehingga ekspresi gen meningkat.
Prototip kelainan ini dijumpai pada limfoma Burkit di mana gen myc pindah ke tempat berdekatan dengan pusat kontrol transkripsi gen imunoglobulin (Ig). Ekspresi c-myc juga meningkat bila ia pindah ke lokasi yang berdekatan dengan gen reseptor sel T (TCR) seperti sering dijumpai pada leukemia sel T.
Cara kedua adalah apabila potongan-potongan gen yang berpindah tempat melakukan fusi dan menghasilkan protein hibrid, mirip dengan pembentukan hibrid potongan gen seluler dengan gen struktural virus (gambar 2).
Terjadinya kromosom Philadelphia merupakan contoh kelainan yang terjadi dengan cara ini, di mana proto-onkogen abl melakukan fusi dengan abl dan membentuk onkogen bcr-abl (gambar 3), sehingga dalam hal ini translokasi mengakibatkan perubahan struktur gen dan pembentukan protein abnormal.
Gambar 3 : Kromosom Philadelphia. Proto-onkogen abl pindah (translokasi) dari kromosom 9 ke lokus bcr pada kromosom 22

Dalam melakukan fusi tidak selalu kedua bagian gen hibrid itu memberikan kontribusi pada aktivitas biokimiawi protein hibrid, salah satu bagian mungkin saja merupakan bagian yang pasif, misalnya hanya mengganggu fungsi atau menggantikan domain yang fungsional.
Translokasi tidak selalu menghasilkan fusion gene, tetapi mengakibatkan ekspresi gen bersangkutan meningkat karena diaktivasi oleh proto-onkogen yang berdekatan yang fungsinya meningkatkan ekspresi gen. Contoh yang baik adalah translokasi gen c-myc dari kromosom 8 ke kromosom 14, atau translokasi gen bcl2 dari kromosom 18 ke kromosom 14 dekat lokasi gen IgH. (gambar 4)
Gambar 4: Translokasi bcl2 dari kromosom 18 ke kromosom 14 pada lokasi gen IgH terjadi pada limfoma folikuler.

3. Aktivasi Akibat Amplifikasi Gen
Amplifikasi proto-onkogen meningkatkan jumlah template yang diperlukan untuk transkripsi mRNA. sehingga dengan demikian meningkatkan jumlah produk yang dihasilkan oleh sel.
Karena amplifikasi bisa sampai lebih dari 100 kali, produk gen yang dihasilkan juga menjadi banyak. Di samping itu, beberapa alel yang diamplifikasi biasanya mengalami mutasi pada domain sandi sebelum terjadi amplifikasi, sehingga mutasi tersebut juga turut diamplifikasi. Amplifikasi gen semacam ini sering dijumpai pada berbagai jenis kanker
4. Aktivasi Akibat Point Mutation
Banyak tumor pada manusia mengandung gen ras yang mengalami point mutation yang mengubah satu residu asam amino, biasanya pada residu 12, 13 atau 61. Point mutation ini telah terbukti bertanggung jawab atas terjadinya transformasi dengan kemampuan lebih dari 100 kali lipat.
Aktivasi gen ras akibat mutasi ini sering dijumpai pada kanker. Proto-onkogen ret merupakan contoh lain tentang bagaimana point mutations dapat mengaktifkan onkogen. Ret menyandi reseptor permukaan yang memiliki domain intrasitoplasmik dan domain ekstraseluler. Domain intrasitoplasmik reseptor ini merupakan protein kinase yang dapat diaktifkan dengan pengikatan domain ekstrasel oleh ligand-nya.
Mutasi gen ret mengakibatkan domain ekstrasel hilang dan domain intrasel berada dalam keadaan aktif terus menerus; di samping itu domain ini kehilangan spesifisitas kinase, sehingga dapat dianggap sebagai salah satu contoh perubahan kualitatif gen akibat mutasi. Mutasi ret dikaitkan dengan tumor endokrin herediter, termasuk di antaranya multiple endocrine neoplasia (MEN) tipe IIA dan IIB.
PATOGENESIS PERUBAHAN PROTO-ONKOGEN MENJADI ONKOGEN
Seperti telah diuraikan di atas berbagai cara dapat mengubah proto-onkogen menjadi onkogen. Ada 2 hipotesis bagaimana perubahan itu mengakibatkan gangguan fungsi gen.
Hipotesis yang pertama adalah model kuantitatif, di mana patogenesis disebabkan oleh meningkatnya aktivitas gen dan produknya, sedangkan hipotesis kedua didasarkan atas perubahan spesifisitas atau fungsi sebenarnya dari produk gen bersangkutan.
Banyak kanker yang disebabkan perubahan gen secara kuantitatif, dan pada umumnya perubahan itu disebabkan mutasi yang berakibat peningkatan fungsi (gain of function mutations), sehingga gen bersangkutan diekspresikan berlebihan dan berfungsi secara terus menerus.
Berbeda dengan mutasi gen supresor (tumor suppresor genes) yang pada kanker umumnya mengalami inaktivasi atau loss of function, pada onkogen umumnya terjadi gain of function.
Ada beberapa bentuk aktivitas berlebihan,, yaitu: gain of function melalui kelainan ekspresi gen atau gain of function melalui perubahan struktur protein.
- Gain of function akibat perubahan ekspresi gen
Beberapa bentuk kerusakan genetik yang mengenai proto-onkogen dapat mengubah ekspresi gen. Transduksi dan mutagenesis akibat sisipan (insertional mutagenesis) oleh retrovirus menyebabkan fungsi transkripsi gen bersangkutan dapat dipengaruhi atau dikendalikan oleh virus.Demikian pula translokasi kromosom dapat mengubah fungsi transkripsi gen-gen yang mengalami translokasi
Pada keadaan-keadaan tersebut ekspresi gen dan aktivitasnya meningkat bahkan tidak terkendali (terus menerus aktif). Keadaan yang sama dapat timbul bila terjadi amplifikasi gen. Pada umumnya DNA yang mengalami amplifikasi sangat peka terhadap rangsangan transkripsi, bahkan tidak dapat dikontrol. Hasilnya sama dengan yang diakibatkan gain of function mutations, yaitu ekspresi gen secara terus menerus.
Adakalanya ekspresi gen berlebihan itu tidak disebabkan oleh translokasi maupun amplifikasi. Salah satu kemungkinan mekanisme lain adalah perubahan minimal pada faktor transkripsi gen bersangkutan yang lebih sulit dideteksi dibanding amplifikasi atau translokasi. Akibat hal-hal di atas adalah bahwa sel tidak mampu mengontrol aktivasi gen yang berlebihan sehingga terjadi transformasi. - Gain of function akibat perubahan struktur protein.
Beberapa bentuk kerusakan gen dapat mengenai domain sandi proto-onkogen, di antaranya kerusakan yang disebabkan mutasi, kehilangan atau terjadinya fusi dengan gen lain.
Perubahan-perubahan itu menghasilkan hal yang sama, yaitu: protein mutant yang sulit dikendalikan oleh regulator-regulator yang dalam keadaan normal mampu menekan aktivasi gen bersangkutan.
Konsekuensi fungsional adalah sama dengan yang disebabkan deregulasi ekspresi gen, yaitu aktivitas gen yang meningkat dan terus menerus yang tidak dapat dihentikan oleh regulator yang normal (lihat contoh kromosom Ph pada gambar 3).
Salah satu contoh jelas yang lain adalah alel proto-onkogen ras yang mengalami mutasi. Protein yang disandi oleh gen ras merupakan senyawa yang fungsinya meneruskan sinyal yang dirangsang oleh pengikatan guanosine triphosphate (GTP) kemudian menghentikan sinyal itu melalui hidrolisis GTP terikat menjadi GDP (guanosine diphosphate).
Hidrolisis dimaksudkan untuk membatasi transduksi sinyal oleh Ras agar tidak berlebihan. Protein lain yang disebut GAP (GTPase activating protein) berinteraksi langsung dengan protein Ras untuk meningkatkan hidrolisis hingga beberapa kali lipat.
Mutasi proto-onkogen ras menjadi onkogen menyebabkan protein Ras tidak mampu menghidrolisis GTP dengan tidak memberikan response terhadap GAP. Konsekuensinya adalah ras meneruskan sinyal secara terus menerus. sama halnya dengan akibat yang disebabkan gain of function mutation.
Kelainan yang sama dapat dijumpai pada proto-onkogen yang menyandi protein kinase, misalnya erbB1 (produknya merupakan reseptor faktor pertumbuhan epidermal, EGFR) yang menjadi aktif apabila kehilangan domain ligand-bindingnya; gen abl yang apabila melakukan fusi dengan gen bcr menghasilkan chimeric fusion protein yang mampu mengaktifkan protein tirosin kinase secara terus menerus yang berakibat pertumbuhan tak terkendali; gen raf (produknya merupakan serine-threonine protein kinase dalam sitoplasma) yang menjadi aktif terus menerus apabila protein/produknya kehilangan domain regulator atau apabila regulatornya diganti.
Banyak translokasi pada leukemia yang menghasilkan hibrid antara 2 jenis faktor transkripsi, yang berakibat perubahan kualitatif dari fungsi gen masing-masing. Tabel 1 menunjukkan contoh beberapa jenis onkogen yang di-amplifikasi pada kanker.
| ONKOGEN | TUMOR |
|---|---|
| C-MYC | Leukemia, kanker payudara, lambung, paru dan kolon, neuroblastoma,glioblastoma |
| N-MYC | Neuroblastoma, retinoblastoma, kanker paru |
| L-MYC | Kanker paru |
| ERBB | Glioblastoma, karsinoma sel skuamosa |
| ERB-β2 | Kanker payudara, kelenjar liur, kanker ovarium |
| INT-2 | Kanker payudara, karsinoma sel skuamosa |
| HST | Kanker payudara, karsinoma sel skuamosa |
| PRAD-1 | Kanker payudara dan karsinoma sel skuamosa |
| ABL | K562, chronic myelogenous leukemia cell line |
| MYB | Kanker kolon, leukemia |
| ETS-1 | Limfoma |
| RASH | Kanker kandung kemih |
| RASK | Kanker paru, ovarium, kanker kandung kemih |
| RASN | Cell line kanker payudara |
| MDM-2 | Sarkoma |
PERAN ONKOGEN PADA TUMORIGENESIS
Sel mamalia pada umumnya berada dalam keadaan tenang sampai sel itu menerima sinyal dari luar yang mengubah perilakunya secara spesifik.
Karena itu, pertumbuhan sel, diferensiasi dan seringkali juga ketahanan hidup sebuah sel normal bergantung pada sinyal-sinyal eksternal tersebut. Proses komunikasi sel itu mulai bila satu sel memproduksi molekul sinyal, seringkali dalam bentuk hormon, yang kemudian berikatan dengan reseptor bagi sinyal bersangkutan yang terdapat pada permukaan sel sasaran.
Pengikatan hormon pada reseptornya mengubah reseptor dari keadaan dorman menjadi keadaan aktif dengan cara merangsang fungsi biokimiawi intrinsik reseptor bersangkutan. Reseptor yang teraktivasi kemudian memodifikasi jalur sinyal yang mengontrol ekspresi gen, siklus sel, metabolisme, struktur sitoskeleton, adhesi maupun migrasi sel dan dalam keadaan normal aktivasi dan inaktivasi jalur ini diatur melalui fosforilasi dan defosforilasi secara bergantian sesuai kebutuhan.
Diduga bahwa proto- onkogen tertentu menyandi produk-produk yang merupakan unsur-unsur penting dalam jalur traaansduksi sinyal pertumbuhan, dan bahwa mutasi yang mengakibatkan peningkatan aktivitas jalur ini dapat mengubah proto-onkogen menjadi onkogen.
Mutasi onkogenik mengubah kemampuan sandi gen-gen bersangkutan sehingga protein yang diproduksinya mengalami berbagai perubahan. Salah satu perubahan seperti telah diuraikan di atas adalah diekspresikannya gen secara terus menerus dan protein yang dihasilkannya yang disebut secara umum onkoprotein, kehilangan kemampuan untuk mengatur fosforilasi/ defosforilasi. Ekspresi terus menerus gen-gen bersangkutan di interpretasikan oleh sel sebagai sinyal untuk terus tumbuh, karena itu onkogen mempunyai dampak dominan positif bagi pertumbuhan sel dengan menirukan fungsi sinyal mitogenik.
Onkogen yang terlibat dalam transduksi sinyal
Identifikasi berbagai onkogen yang terlibat dalam pertumbuhan kanker disusul kemudian dengan bertambahnya pemahaman mengenai fungsi berbagai onkogen bersangkutan. Beberapa gen yang sering merupakan sasaran lesi onkogenik adalah gen yang terlibat dalam transduksi sinyal. Mutasi onkogenik seringkali melibatkan gen yang menyandi faktor pertumbuhan dan atau reseptornya, protein yang meneruskan sinyal transduksi dalam sitoplasma hingga ke nukleus
Golongan faktor pertumbuhan
Hubungan pertama antara onkogen dengan protein seluler yang aktivitas fisiologiknya sudah dikenal adalah penemuan produk onkogen sis yang dikenal sebagai PDGF (platelet derived growth factor).
PDGF merupakan faktor pertumbuhan utama bagi fibroblast dalam biakan sel. Gen sis pertama kali diidentifikasi sebagai onkogen simian sarcoma virus, yang diisolasi dari fibrosarkoma berasal dari monyet. Penelitian- penelitian selanjutnya membuktikan bahwa ada kesamaan antara protein produk onkogen sis dengan PDGF dalam hal sekuen asam amino, sehingga kedua protein itu dianggap homolog.
Penelitian tentang aktivitas biologik proto-onkogen sis menunjukkan bahwa apabila protein produk sis ini direkayasa secara molekuler, ia mampu menginduksi transformasi sel.. Hal itu membuktikan bahwa sis/PDGF menginduksi transformasi ganas dengan merangsang jalur transduksi faktor pertumbuhan normal secara terus menerus. Hal penting lain yang dibuktikan adalah bahwa produk gen sis dapat berikatan dengan reseptornya secara internal yang berakibat stimulasi autokrin.
Faktor pertumbuhan lain yang juga berperan pada transformasi adalah keluarga faktor pertumbuhan fibroblast (FGF), faktor pertumbuhan epidermal (EGF) dan faktor pertumbuhan hemopoetik. Faktor pertumbuhan hemopoetik dapat menjadi onkogenik melalui penyisipan promoter retrovirus, misalnya pada leukemia.
Sasaran sisipan retrovirus adalah faktor pertumbuhan sel T (IL-2), CSF (IL-3), GM-CSF dan M-CSF. (lihat tabel 2)
Tabel 2: Faktor pertumbuhan yang mempunyai potensi onkogenik *
| PRODUK PROTO-ONKOGEN | BERAT MOLEKUL |
|---|---|
Keluarga PDGF :
|
|
Keluarga FGF
|
|
Keluarga EGF
|
|
Keluarga Wnt
|
|
Faktor pertumbuhan hempoetik
|
|
Golongan reseptor faktor pertumbuhan
Telah diketahui bahwa proses aktivasi reseptor faktor pertumbuhan terjadi melalui dimerisasi. Gen reseptor faktor pertumbuhan yang mengalami mutasi menghasilkan reseptor abnormal. Dari berbagai penelitian dapat diketahui bahwa reseptor faktor pertumbuhan yang dihasilkan oleh gen mutant (onkogen) dapat kehilangan beberapa bagian N-terminal atau C-terminal, atau mengalami substitusi beberapa asam amino, tetapi tetap mempertahankan domain PTK (protein tirosin kinase) utuh yang terus menerus aktif. Selain substitusi, gen ini juga sering mengalami rekombinasi.
Salah satu contoh di antaranya adalah onkogen c-erbB yang menghasilkan onkoprotein EGFR abnormal berupa reseptor tanpa domain ekstraseluler. Onkogen neu (disebut juga erb-B2 atau HER-2) mengalami single point mutation yang mengubah valine pada residu transmembran menjadi asam glutamat. Substitusi ini menginduksi dimerisasi onkoprotein neu pada membran sel sehingga menyerupai induksi proses aktivasi oleh pengikatan dengan faktor pertumbuhan.
Konsekuensinya adalah terjadi aktivasi walaupun tidak ada rangsangan faktor pertumbuhan dari luar. Contoh onkogen reseptor PTK yang lain adalah onkogen ret seperti telah disinggung di atas yang berperan pada kanker endokrin herediter (multiple endocrine neoplasia). Onkogen ret ini merupakan pengecualian onkogen yang diturunkan, karena pada umumnya hanya kelainan pada tumor suppressor gene yang dikaitkan dengan kanker herediter.
Golongan protein tirosin kinase intrasitoplasmik
Golongan ini juga disebut protein-tirosin kinase (PTK) non-reseptor. Gen golongan ini menyandi protein-tirosin kinase yang tidak terdapat atau menembus membran sel tetapi terdapat di dalam sitoplasma, beberapa di antaranya berhubungan dengan bagian sitoplasmik dari membran sel.
Aktivitas kinase dan kemampuan transformasi gen ini dikontrol melalui fosforilasi dan defosforilasi pada 2 residu penting tirosin, yaitu tirosin-416 dan tirosin-527. Kehilangan fungsi kontrol ini menyebabkan aktivitas kinase meningkat dan dapat berakhir dengan transformasi sel. Termasuk golongan ini adalah keluarga Src, Lck dan lain-lain
Salah satu PTK intrasitoplasmik yang sudah sangat dikenal adalah gen abl yang sudah diuraikan di atas. Konsekuensi fusi abl dengan bcr (lihat gambar 3) adalah bahwa bcr meningkatkan oligomerisasi protein Bcr-Abl dan aktivasi domain tirosin kinase dari Abl melalui autofosforilasi. Akibat autofosforilasi ini, protein Bcr-Abl berikatan dengan protein Grb2 yang berfungsi sebagai protein sinyal sehingga menginduksi proliferasi dan memperpanjang ketahanan hidup.
Golongan transduser intraseluler (pengikat guanine)
Salah satu jenis gen yang menduduki tempat penting dalam riset awal kanker adalah gen RAS. Fungsi RAS yang pertama kali diketahui adalah kemampuannya untuk mengikat nukleotida guanine. Mutasi gen RAS yang mengakibatkan aktivasi berlebihan merupakan kelainan genetik yang paling sering dijumpai pada kanker, dan karena fungsinya yang amat penting pada pertumbuhan kanker, berbagai penelitian tentang RAS telah dilakukan dan mengungkapkan berbagai jalur ras dalam transduksi sinyal dalam sel (gambar 5, dimodifikasi dari Perkins & Stern.)
Gambar 5: Diagram jalur RAS. Huruf-huruf yang dicetak miring adalah contoh onkogen atau gen dengan kemampuan transformasi bila diekspresikan berlebihan atau di-amplifikasi .

Mengambil contoh gen RAS di atas, salah satu mutasi yang sering dialaminya adalah point mutation yang mengubah asam amino Gly menjadi Val pada posisi 12, 13 atau 59 hingga 61. Pada beberapa dari posisi ini, khususnya posisi 12 dan 61, substitusi berbagai jenis asam amino meningkatkan potensi Ras untuk transformasi. Pada umumnya mutasi-mutasi ini mengganggu hidrolisis GTP pada siklus pertukaran RAS-GNP (gambar 6)
Gambar 6: Interaksi protein Ras dengan guanine nucleotide

Mutasi yang mengakibatkan aktivasi Ras berlebihan (activating mutation) menurunkan aktivitas GTPase atau meningkatkan kecepatan pertukaran GDP terikat dengan GTP bebas. Keduanya diduga meningkatkan jumlah GTP terikat dan karena itu meningkatkan aktivitas Ras.
Dari analisis struktur protein Ras terungkap bahwa asam amino yang terkena mutasi adalah bagian protein Ras yang mengikat guanine sehingga berakibat protein Ras berada dalam keadaan terikat dengan GTP dan karenanya berada dalam keadaan terus menerus aktif dan meneruskan sinyal pertumbuhan.
Banyak protein lain yang termasuk transduser intraseluler, misalnya protein serine/threonine kinase, bahkan sebagian besar aktivitas protein-kinase seperti disebut di atas pada sel mamalia berakibat fosforilasi serine-/threonine kinase . Lebih dari 100 jenis enzim serine/threonine kinase telah ditemukan, sebagian besar di antaranya berperan penting pada berbagai jenis proses metabolisme.
Salah satu di antara onkogen yang menyandi golongan enzim ini adalah keluarga onkogen raf. Ada 3 jenis onkogen raf, yaitu c-raf-1, A-raf dan B-raf, Ketiga jenis protein yang dibentuknya identik dalam domain kinase yang terletak pada bagian carboxy-terminal masing-masing protein, dan bagian inilah yang mengatur aktivitas Raf -kinase. Mutasi yang mengubah proto-onkogen raf menjadi onkogen pada umumnya terjadi akibat hilangnya (deletion) sekuen amino- terminal dari gen tersebut (gambar 7) yang merupakan domain yang mempunyai aktivitas katalitik (negative regulatory domain).
Gambar 7: Proto-onkogen c-raf-1 dikonversikan menjadi onkogen aktif akibat hilangnya domain regulator amino-terminal.

Gen raf yang buntung ini dapat diaktifkan melalui fusi dengan sekuen gag suatu virus atau fusi dengan berbagai sekuen sandi seluler dalam onkogen raf yang telah diaktifkan pada waktu transfer gen bersangkutan. Tetapi sebenarnya gen raf yang buntung itu sendiri sudah cukup untuk mengaktifkan potensi transformasi onkogen raf. Mutan dengan kemampuan transformasi paling tinggi menunjukkan kehilangan hampir seluruh domain amino-terminal. Hilangnya domain katalitik ini menyebabkan domain kinase berada dalam keadaan terus menerus aktif.
Gen lain dalam golongan serine/threonine kinase adalah keluarga protein kinase C (PKC). Pada saat ini telah diketahui sedikitnya 3 anggota keluarga PKC yang berbeda satu dengan lain dalam aktivitas katalitik maupun fungsinya sebagai regulator. Aktivitas katalitik isotip PKC yang klasik (α, β1, β2 dan γ) memerlukan pengikatan baik dengan kalsium maupun diacylglycerol (DAG), Tetapi PKC yang lainnya seperti PKC-δ dan PKC−ε tidak bergantung pada kalsium dan hanya memerlukan DAG bagi aktivitasnya. Beberapa penelitian membuktikan bahwa PKC juga dapat diaktifkan oleh proteolisis terbatas, sehingga didugaenzim itu mempunyai domain regulator dan katalitik yang berbeda-beda (gambar 8)
Gambar 8: Struktur PKC.

Baik raf maupun PKC berfungsi sebagai efektor penerus sinyal yang dimulai dari pengikatan faktor pertumbuhan dengan reseptornya, melalui aktivasi ras kemudian meneruskan sinyal tersebut melalui kaskade aktivasi enzim-enzim yang terlibat dan berakhir dengan proliferasi sel.
Onkogen nukleus
Onkogen golongan ini merupakan komponen nukleus dari jalur transduski sinyal. Proses pertumbuhan yang berlangsung melalui suatu siklus sel dikendalikan secara ketat, periodik dan spesifik / sesuai fase siklus sel oleh banyaknya dan aktivitas protein tertentu. Di antara protein-protein tersebut termasuk berbagai cyclin dan cyclin dependent kinase (cdk) dan inhibitornya serta faktor transkripsi AP-1 yang terdiri atas jun dan fos.
Pengaturan yang ketat dari siklus sel juga melibatkan berbagai gen yang menyandi berbagai protein yang diperlukan untuk metabolisme dan replikasi DNA, misalnya thymidine kinase, DNA polymerase-α, DNA polimerase-δ dan histone. Pengaturan komponen penting dari mesin siklus sel ini terjadi melalui berbagai mekanisme yang saling terkait, yaitu modifikasi pasca-translasi, hubungan dengan berbagai protein regulator yang bersifat spesifik sesuai stadium (stage specific), degradasi periodik, ekspresi gen yang diinduksi secara berulang dan lain-lain.
Salah satu cara pengaturan faktor transkripsi oleh mesin siklus sel adalah melalui modulasi aktivitas protein E2F oleh kompleks cyclin-cdk. Inaktivasi E2F dilakukan dengan melepaskan pengikatan protein ini dengan RB1 dengan cara fosforilasi Rb1 dengan bantuan cyclin-cdk. Selain itu sebagian protein E2F dapat merupakan substrat langsung bagi kompleks cyclin-cdk spesifik dan fsoforilasinya melepaskan ikatan protein itu dengan DNA. 10 E2F dapat berfungsi sebagai represor maupun aktivator pertumbuhan sesuai dengan fase siklus sel.
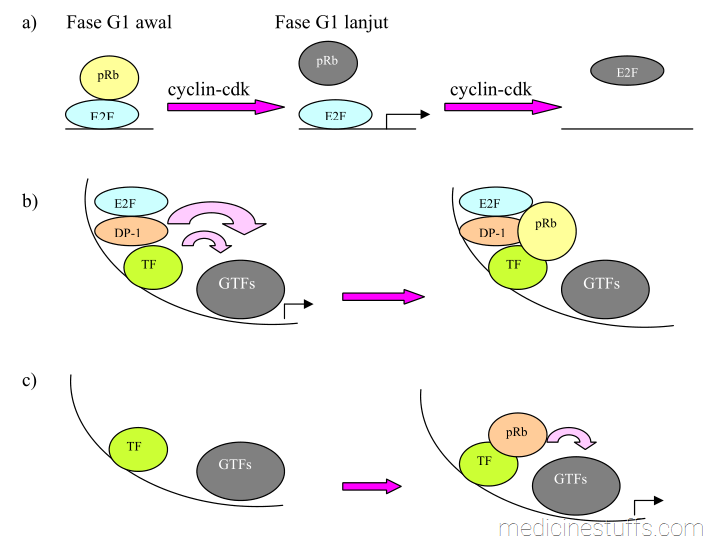
Contoh lain adalah c-myc seperti telah disebut di atas, c- fos dan jun serta AP-1. Gambar 9 memperlihatkan bagaimana protein Rb dan kompleks cyclin-cdk mengatur aktivasi faktor-faktor transkripsi.
Gambar 9: Model pengaturan aktivator transkripsi spesifik sekuen oleh pRb dan cdk.

Gambar 9 memperlihatkan bahwa :
- a) Pengaturan temporal E2F dan transaktivator lain dapat terjadi melalui interaksi berurutan dengan represor seperti pRb dan dengan cyclin-cdk yang dapat berfungsi sebagai represor maupun aktivator transkripsi (warna putih-abu-abu berarti fosforilasi).
- b) Menggambarkan mekanisme represi transkripsi polymerase II dengan perantaraan pRb. Pengikatan pRb pada E2F mengakibatkan hambatan pada E2F dan faktor transkripsi lain (misalnya TF). Pada mekanisme ini pRb mem-blok interaksi antara aktivator dan faktor transkripsi umum (general transcription factors, GTFs). Protein pRB dapat berfungsi sebagai represor bagi transkripsi polimerase I dan DP-1, yang merupakan anggota keluarga E2F untuk membentuk heterodimer E2F.
- c) Pada keadaan lain pRb dapat berfungsi untuk meningkatkan transkripsi promoter spesifik Pada gambar ini, TF berarti faktor transkripsi yang aktivitasnya diatur secara positif oleh pRb.
Dalam golongan ini termasuk faktor transkripsi yang berfungsi baik sebagai regulator positif pertumbuhan sel maupun berperan sebagai regulator negatif diferensiasi sel. Karena fungsi terakhir ini yang agaknya dominan maka ia diberi nama Id (inhibitors of cell differentiation).
Protein Id-helix-loop-helix merupakan antagonis dominan-negatif bagi faktor transkripsi golongan HLH lain yang fungsinya merangsang perkembangan sel sesuai komitmennya menjadi berbagai lineage dan stadium diferensiasi yang diprogramkan. Tetapi Id-helix-loop-helix (Id-HLH) tidak memiliki domain basa seperti di atas karena itu ia berperan sebagai regulator negatif diferensiasi. Fungsi Id helix-loop-helix di-integrasikan dengan jalur pengaturan siklus sel dibawah kendali cyclin dependent kinase dan protein retinoblastoma.
Gambar 10: Protein Id sebagai antagonis dominan-negatif regulator transkripsi bHLH.

Dalam gambar 10 diperlihatkan :
- Protein bHLH mengikat sekuen E-box secara spesifik dalam konfigurasi heterodimer dan berfungsi untuk mengaktivasi ekspresi gen yang terlibat dalam mengatur diferensiasi sel.
- Pada keadaan protein Id berlebihan seperti yang dijumpai pada sel-sel yang sedang berproliferasi, protein b-HLH kelas A praktis terpakai seluruhnya untuk membentuk heterodimer dengan Id. Karena Id tidak memiliki domain basa, heterodimer ini tidak mampu mengikat sekuen E-box, sehingga gen yang terlibat dalam proses diferensiasi dan bergantung pada E-box (E-box dependent) tidak dapat diekspresikan dan berakibat tidak terjadi diferensiasi.
PERAN ONKOGEN DALAM METABOLISME SEL TUMOR
Selain berperan dalam pertumbuhan dan diferensiasi sel. onkogen tertentu juga berperan dalam metabolisme sel. Sejak lama diketahui bahwa sel-sel kanker menunjukkan kelainan dalam pola metabolisme dan menunjukkan uptake glukosa dan glikolisis lebih tinggi dibanding sel-sel normal. Walaupun perubahan metabolik ini bukan merupakan dasar terjadinya kanker, perubahan metabolisme ini dapat mengakibatkan sel- sel kanker dapat hidup terus dan mampu melakukan invasi.
Gambar 11: Peran onkogen dalam metabolisme tumor.

Sel yang mengalami transformasi ganas dan kelainan genetik memerlukan metabolisme khusus untuk berkembang menjadi masa tumor dalam 3 dimensi. Tumor kecil (diameter < 1 mm) maupun bagian-bagian kecil dari tumor besar seringkali memiliki lingkungan mikro yang menunjukkan berbagai metabolit penting seperti oksigen, glukosa dan faktor pertumbuhan. (gambar 11 a) Gambar 11b menunjukkan perubahan berbagai gen yang terlibat dalam pertumbuhan tumor.
Aktivasi beberapa onkogen mengakibatkan deregulasi proliferasi sel, yang seringkali dihubungkan dengan apoptosis bila tidak tersedia faktor pertumbuhan. Hasilnya adalah peningkatan apoptosis (bola hitam), yang menyebabkan tumor tidak bertambah besar. Peningkatan ketahanan hidup sel sebagai akibat perubahan genetik yang mencegah apoptosis, misalnya aktivasi BCL2 atau kehilangan p53, menyebabkan tumor bertambah besar.
Aktivasi faktor transkripsi yang diinduksi oleh hipoksia (hipoxia-inducible transcription factor, HIF-1) akibat hipoksia atau onkogen tertentu menginduksi faktor adaptasi metabolik dan angiogenik, yang mengakibatkan terbentuknya pembuluh-pembuluh darah baru. Akhirnya sel bermigrasi, masuk ke dalam pembuluh darah dan bermetastasis.
Onkogen myc yang seringkali diekspresikan berlebihan pada kanker menyandi faktor transkripsi yang membentuk heterodimer dengan onkogen max untuk mengikat sekuen 5’-GACGTG-3’. Dari berbagai penelitian terungkap bahwa gen LDH-A merupakan sasaran gen myc, dan ekspresinya pada kanker sering meningkat, bahkan sejak lama LDH-A digunakan sebagai petanda adanya transformasi ganas. Ekspresi gen LDH-A diinduksi oleh hipoksia melalui aktivasi HIF-1. Gen myc juga diketahui meningkatkan glikolisis dan produksi laktat.
Aktivasi onkogen H-ras juga menyebabkan peningkatan glikolisis aerobik, merangsang transkripsi gen yang menyandi VEGF (vascular endothelial growth factor) dengan bantuan HIF-1. (gambar 12)
Gambar 12: Tempat pengikatan faktor transkripsi dalam promoter proksimal gen yang menyandi LDH-A. 13

Pada gambar 12 tampak bahwa E-box (5’CACGTG-3’) merupakan inti dari carbohydrate response element yang tumpang tindih dengan tempat pengikatan faktor transkripsi HIF-1, MYC-MAX dan USF. MYC dan HIF-1 dapat secara langsung mengikat elemen cis, sedangkan v-SRC dan H-RAS teraktivasi meningkatkan aktifitas HIF-1 dan faktor-faktor lain yang berikatan dengan elemen-elemen ini dan mengaktivasi glikolisis.
Dengan demikian terbukti bahwa di samping mengakibatkan pertumbuhan tak terkendali dan menimbulkan fenotip abnormal, ekspresi berlebihan beberapa jenis onkogen juga dapat meningkatkan ekspresi berbagai faktor transkripsi yang mengatur produksi berbagai enzim metabolik dan faktor-faktor angiogenik yang diperlukan untuk kehidupan sel-sel kanker selanjutnya.
RINGKASAN
Onkogen adalah bentuk abnormal dari proto-onkogen, yang mempunyai sifat biologis berbeda dari counterpartnya, yaitu memiliki kemampuan untuk transformasi sel menjadi ganas. Perubahan sifat itu dapat disebabkan pertama oleh perubahan kuantitatif, yaitu amplifikasi atau diekspresikan berlebihan, dan kedua oleh perubahan kualitatif, yaitu peningkatan fungsi.
Berbagai mekanisme dapat menyebabkan peningkatan ekspresi dan atau fungsi onkogen, antara lain: translokasi gen ke kromosom lain yang berakibat gen bersangkutan diaktivasi terus menerus, penyisipan (insertion) maupun transduksi gen virus yang juga mengakibatkan hiperaktivitas onkogen bersangkutan. Pada umumnya onkogen diklasifikasikan menurut fungsinya dalam sel.
Onkogen yang berperan dalam tumorigenesis adalah onkogen yang memegang peran penting dalam proses pertumbuhan dan diferensiasi sel, mulai dari gen yang menyandi berbagai faktor pertumbuhan, reseptor faktor pertumbuhan, berbagai enzim intraseluler yang berfungsi dalamtransdusi sinyal maupun faktor transkripsi.
Di samping berperan dalam tumorigenesis, berbagai onkogen juga memegang peran penting dalam metabolisme sel-sel kanker. Produk berbagai onkogen sering secara langsung mempengaruhi metabolisme sel seperti transpor glukosa, glikolisis dan proses metabolisme lain.
